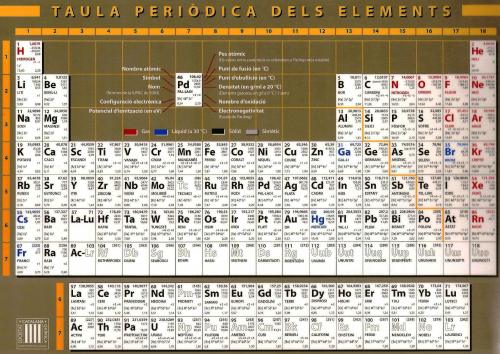
La taula periòdica dels elements es comença a estudiar a segon curs d’ESO. És, doncs, quelcom que forma part d’allò que diem cultura mitjana d’un individu, en el mateix sentit que aquest individu pot distingir el romànic del gòtic o diferenciar entre la música de Chopin i la d’Ellington. Com diu un amic meu, són coses que serveixen per no parlar del temps a l’esmorzar. Més d’un no en deu tenir gaire bon record, perquè va haver d’aprendre’s part de la taula com segurament també els rius d’Europa o les comarques catalanes. Ja se sap: el col·le!
Què fa tan important la taula dels elements, tanmateix?
Al segle XIX, la Química ja havia deixat enrere el misticisme dels alquimistes i s’havia imbuït de l’esperit mecanicista de tota bona ciència després de Newton. Però pecava encara d’un excés d’empirisme, sense teories consistents que lliguessin tot el coneixement pràctic. Abans que Dimitri Ivánovich Mendeléiev, nascut un dia com avui, -un 8 de febrer de 1834- proposés la taula periòdica dels elements tal i com ara la coneixem, la Química era una ciència en plena adolescència, desordenada, aparentment contradictòria, irritant i irritable, necessitada de models a imitar i de lleis a seguir (Perdoneu-me l’analogia psicològica, però les ciències, les diferents disciplines, mostren sovint característiques molt humanes que han seduït molts estudiosos de l’epistemologia).
Els anomenats elements químics són les peces amb les quals hom construeix tota la infinita variabilitat de les diferents substàncies. El ferro és un element químic perquè totes les partícules que el formen són idèntiques però el rovell no ho és perquè les seves molècules estan formades per àtoms de ferro i àtoms d’oxigen, un altre element químic. Per construir res amb el conegut LEGO, necessitem unes peces en particular i no pas unes altres i les peces que necessitem han d’estar muntades amb un ordre i una estructura determinada i única. Per construir una molècula d’aigua necessitem un àtom d’oxigen i dos d’hidrogen. El rovell està format, quan és vermellós, per dues de ferro i tres d’oxigen. En l’aigua, a més, cada àtom d’hidrogen està lligat al d’oxigen -i no pas entre ells- formant un angle molt precís. La geometria és important: tots tres àtoms podrien formar una línia recta, però no ho fan, i això determina absolutament les propietats de l’aigua. Ja es veu, doncs, com el LEGO i la síntesi química tenen molt a veure. Conèixer totes les peces del joc, és a dir, tots els elements, saber-ne les propietats, conèixer quins es poden acoblar (enllaçar és el nom que s’hi escau) amb quins i de quina manera -en línia recta o angularment- és fonamental si volem construir res. D’altra banda, podríeu imaginar jugar a les cartes sense que en sabéssim quines i quantes té el joc? Doncs això exactament és el que els succeïa als contemporanis de Mendeléiev.
Al seu torn, els àtoms, tots ells, estan formats de tres partícules: al bell mig, al nucli, els protons (amb càrrega positiva) i els neutrons (sense càrrega), i envoltant el nucli, els electrons (negatius). Tots els àtoms tenen, llevat que vulguem que no sigui així, tantes càrregues positives com negatives, és a dir, el nombre de protons i d’electrons és el mateix. L’àtom més senzill -i, per la mateixa raó, el més abundant a l’univers- és l’hidrogen: el formen un protó i un electró. El següent en complexitat és l’heli, escàs a la Terra però abundant al Sol: dos protons i dos neutrons al nucli i dos electrons envoltant-los. Ara bé, els dos protons, essent càrregues positives, es repel·lirien. Afortunadament, l’àtom d’heli té dos neutrons al nucli que podríem dir que actuen com el ciment entre els maons (podeu imaginar que aquesta és una simplificació molt, molt, molt gran, però crec que útil). Les coses sempre són més complicades, tanmateix: en realitat hi ha dos àtoms amb dos protons. Ambdós es diuen Heli perquè qualsevol àtom amb dos protons hem acordat de dir-li heli. Tots dos manifesten propietats químiques molt similars, tant que caldria filar molt prim per distingir-los. Però són diferents, perquè un té un neutró i l’altre en té dos. Un i l’altre diem que són isòtops, una forma culta de dir que ocupen el mateix (iso) lloc (topos) en el nostre joc de cartes, la taula periòdica. En el cas de l’heli, les coses són senzilles perquè més del 99% dels àtoms tenen dos neutrons al nucli. No sempre és així, però, i, per exemple, tots els àtoms de clor tenen 17 protons al nucli però un 75,8% tenen a més a més 18 neutrons i el restant 24,2% en tenen 20. Els primers tenen, per tant, 35 partícules al nucli i els segons en tenen 37, però com que sempre que tenim clor, els dos tipus d’àtoms estan barrejats en la proporció esmentada (75,8% i 24,2%), el clor sembla que tingui 35,45 partícules al nucli. Bé, no es parteix cap partícula, però ja sabeu com va això de les mitjanes. Aquest nombre, 35,45, expressat en unes unitats específiques, és la massa atòmica del clor. La de l’hidrogen és 1 i una mica més perquè també hi ha isòtops i la de l’heli és, arrodonint, 4. A mesura que posem més protons, calen també més neutrons perquè el nucli no peti; i la massa va augmentant amb la complexitat dels àtoms. El ferro té una massa de 55,8, el tungstè que forma el fil de les antigues bombetes incandescents té una massa de 183,4 i l’urani, de 238 i escaig. Però no puja gaire més amunt, perquè arriba un punt que la construcció no s’aguanta… o almenys això sembla… de moment!
En temps de Mendeléiev tot això dels protons, neutrons i electrons no es coneixia. L’únic que es coneixia -i no de tots els elements- és que el clor, per exemple, tenia una massa 35,45 vegades més gran que l’hidrogen. Aquest era un fet palesat empíricament: ningú no en sabia les raons. Per no saber, ni tan sols se’n sabia de tots els elements: el gal·li, el germani i l’escandi no es coneixien. De fet, ningú ni tan sols podia sospitar-ne l’existència. Fixeu-vos com és d’impossible saber si falta una carta en un joc desconegut. Per adonar-nos-en, caldria ordenar-les a partir de detectar-hi regularitats. Mendeléiev va ordenar tots els elements coneguts segons l’ordre creixent de massa atòmica. Sense saber-ho, doncs, els va ordenar per complexitat. Fent-ho així, es va adonar que les propietats físiques (com ara punts de fusió i ebullició) i químiques (com ara qui s’enganxa amb qui) seguien un patró que variava lentament i es tornava a repetir, com els diferents pals d’un joc de cartes espanyoles. Avui col·loquem el fluor, el clor i el brom en una mateixa columna (un mateix pal) perquè tenen propietats molt semblants i el sodi a sobre del potassi per la mateixa raó, però molt allunyats dels primers. Entremig, per exemple, hi tenim de costat el nitrogen, l’oxigen i el fluor, cadascun en una columna (un pal) diferent.
A la seva taulade Mendelèiev hi apareixien forats. Però va tenir la intuïció de veure’ls com a forats, no pas com a excepcions a la regla. L’existència de forats l’hagués pogut desanimar o, potser, animar a buscar altres regularitats, tot allunyant-lo de la solució, però no va ser així. Aquest és un punt molt important. Estava tan convençut de la potència de la seva teoria que fins i tot va donar nom provisional als element desconeguts. Fou tot un atreviment! Si hagués sabut alguna cosa dels protons, ho hagués tingut més fàcil, perquè cada àtom té un protó més que l’anterior, però recordeu que pel mig hi ha els neutrons i, a sobre, els isòtops. No podem saber, per tant, si entre una massa 47,87 i una 50,94 hi haurà o no una de corresponent en un àtom intermedi. La seva va ser realment tota una gosadia, digna del premi Nobel, que mai no va obtenir, però això són figues d’un altre paner.
Òbviament va ser criticat amb furor. Els científics poden ser molt desagradables i al capdavall la seva podia haver estat una de tantes teories entre el marasme químic del segle XIX, però amb el temps, els forats es van anar omplint amb el descobriment de nous elements. Quan en ciència una teoria prediu coses que acaben complint-se, tothom, tard o d’hora, tothom sense excepció (els més tossuts també s’acaben morint), acaba acceptant la teoria. Tanmateix es va haver d’esperar fins a ben entrat el segle XX per explicar les raons de la taula periòdica dels elements, però ara caldria parlar de la física quàntica, probablement una de les creacions intel·lectuals més impressionants i extraordinàries de la humanitat. No ens aclaparem.
Deixem-ho, doncs, de moment!
























































És molt fort com certs avenços científics o tecnològics s’urgeixen d’una “idea feliç”. Dient això no vull treure ni una mica de mèrit a ningú per que és evident que aquestes idees particulars ( els descobriments són d’un o uns no d’una comunitat) és formulen com a resultat d’un estudi i treball exhaustiu. També hi ha moments de sor, la radiografia de les peses de balança per posar un exemple. Tot i així l’investigador ha d’obtenir una reflexió productiva després d’aquest esdeveniment i saber distingir una casualitat d’un descobriment.
Però sempre tindrem el dubte, ja que l’atzar i la sort són una realitat i per sort aquella persona era allí en el moment oportú…
Retroenllaç: Els noms dels elements — Tonilog (el blog del Toni)